3. Строение вещества

На протяжении многих веков в сознании человека господствовали натурфилософские представления об атомах как мельчайших, неделимых, простейших по составу и неизменных «кирпичиках» вещества. Первоначально атомное учение предполагало существование только одного вида мельчайших частиц - атомов, из которых образуются все тела окружающего мира. Но уже в самом начале развития химии на основе атомного учения оказалось, что для строго количественного объяснения многих свойств представлений о «двухступенчатой» (атом - макротело) дискретной организации вещества явно недостаточно. Все более четким становилось предположение о существовании наряду с атомами еще одного вида частиц вещества - молекул - сложных микрочастиц, состоящих из двух или нескольких атомов. Химические превращения вещества стали трактоваться как процессы образования молекул из атомов, как процессы перестройки молекул.
Молекула - наименьшая устойчивая частица вещества, сохраняющая его свойства. Установление связи между структурой и свойствами на молекулярном уровне строения веществ - одна из основных задач химии. В зависимости от строения и состава молекулы обладают разной степенью устойчивости по отношению к внешним воздействиям, что определяет многие их свойства. Исследование устойчивости молекул раскрывает их природу и реакционную способность.
В современной химии изучаются не только простейшие молекулы, состоящие из двух или нескольких атомов, что характерно для неорганических соединений, но и более сложные молекулярные образования из десятков, сотен и даже тысяч атомов, которые встречаются в органической химии и, особенно в биохимии.
Химия изучает процессы превращения молекул при взаимодействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного поля), во время которых образуются новые химические связи.
Атомно-молекулярное учение позволило объяснить основные понятия и законы химии. С точки зрения атомно-молекулярного учения химическим элементом называется каждый отдельный вид атомов. Важнейшей характеристикой атома является положительный заряд его ядра, численно равный порядковому номеру элемента. Значение заряда ядра служит отличительным признаком для различных видов атомов, что позволяет дать более полное определение понятия элемента.
Химический элемент - совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет своё название и символ, которые приводятся в Периодической системе элементов Д. И. Менделеева.
Ko времени открытия Периодического закона Д. И. Менделеевым (1869) было известно 63 элемента. Именно атомный вес был выделен им как свойство атомов, определяющее периодический характер изменения свойств химических элементов, а также образуемых ими простых и сложных веществ. Менделеев определял химические элементы как «материальные части простых или сложных тел, которые придают им известную совокупность физических и химических свойств». Открытие Менделеева позволило предвидеть существование, a также свойства ряда неизвестных в то время элементов и послужило научной основой для их классификации.
Но в окружающей нас природе изолированные атомы встречаются крайне редко. Атомы почти всех элементов «стремятся» соединиться, образуя молекулы или другие более сложные химические частицы. Принято говорить, что при этом между атомами возникают химические связи. Химические связи - взаимодействия, которые соединяют атомы в единые более сложные химические частицы.
Не углубляясь в детали проблем химической физики, перечислим только трактовки в ней двух основных типов химической связи с учетом современных достижений электронной физики. Первым из них можно назвать ионный тип, когда происходит передача электрона от одного атома к другому, и они превращаются в разноименно электрически заряженные ионы - отрицательно заряженный анион и положительно заряженный катион. Примером такой связи может служить двухатомная молекула, состоящая из соединения одного атома щелочного металла и одного атома галогена. В частности, если мы имеем один нейтральный атом щелочного металла натрия с одним валентным электроном, который сравнительно слабо связан со своим ионом, а с другой стороны - нейтральный атом галогена, например, хлора или брома, у которых имеется одно пустое место в недостроенной наружной электронной подоболочке, то при сближении атома натрия с атомом хлора происходит передача электрона от натрия к атому хлора и они превращаются, соответственно, в катион и анион. Последние притягиваются кулоновскими силами и тем самым образуют молекулу с ионной связью, т.е. молекулу поваренной соли NaCl. Данный тип химической связи и называется ионной гетерополярной связью.
Однако в твердом состоянии анионы и катионы нельзя считать жесткими сферами, т. е. атомными частицами с неперекрывающимися электронными оболочками. Из-за значительного перекрытия этих оболочек межатомная связь в ионных кристаллах зависит от двух противодействующих факторов: во-первых, кулоновского притяжения аниона и катиона и, во-вторых, взаимного отталкивания. Энергия последнего была детально просчитана Борном и Майером и дается выражением:
A ехр(-R/b),
где А и b - эмпирические константы, а R - расстояние между центрами соседних аниона и катиона. На рис. 9 приведен график полной потенциальной энергии их взаимодействия, откуда следует, что результирующий потенциал имеет четкий минимум на расстоянии R0, которое соответствует параметру решетки кристалла, т. е. расстоянию между центрами ближайших соседних катионов и анионов. Из результирующей кривой энергии связи также видно, что на близких расстояниях R < R0 наблюдается резкое отталкивание, а на больших расстояниях, когда R > R0 - типичное кулоновское притяжение.
 |
|
Рис. 9. Вклады кулоновских сил притяжения и отталкивания в межатомный потенциал ионных кристаллов |
Вторым основным типом химической связи является ковалентная, или гомеополярная, связь. В этом случае происходит не передача электрона от одного атома к другому, а образование общей молекулярной электронной оболочки, когда внешние электроны обоих реагирующих атомов как бы коллективизируются в ней. В результате такой коллективизации происходит понижение энергии в системе внешних электронов молекулы. Уменьшение суммарной энергии в молекулярной электронной оболочке численно равно некоторой величине, в которую, кроме обычной кулоновской энергии, входят еще произведения соответствующих волновых функций электронов с обменом у них координат соединяющихся атомов, поэтому данный тип связи можно назвать обменной связью.
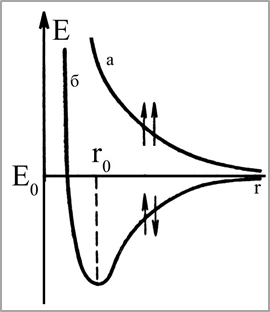
Впервые приближенный расчет такой связи был произведен в 1927 году В. Гейтлером и Ф. Лондоном для молекулы водорода. Они сначала рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии друг от друга. При этом условии можно учитывать только взаимодействие каждого электрона со «своим» ядром, а всеми остальными взаимодействиями (взаимным отталкиванием ядер, притяжением каждого электрона к «чужому» ядру, взаимодействием между электронами) можно пренебречь. Тогда оказывается возможным выразить зависимость волновой функции рассматриваемой системы от координат и тем самым определить плотность общего электронного облака в любой точке пространства. Далее Гейтлер и Лондон предположили, что найденная ими зависимость волновой функции от координат сохраняется и при сближении атомов водорода. При этом, однако, необходимо уже учитывать и те взаимодействия (между ядрами, между электронами и т. д.), которыми при значительном удалении атомов друг от друга можно было пренебрегать. Эти дополнительные взаимодействия рассматриваются как некоторые поправки («возмущения») к исходному состоянию электронов в свободных атомах водорода. В результате Гейтлер и Лондон получили уравнения, позволяющие найти зависимость потенциальной энергии Е системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. При этом оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спинов (рис. 10, кривая а) сближение атомов приводит к непрерывному возрастанию энергии системы. В этом случае для сближения атомов требуется затрата энергии, так что такой процесс оказывается энергетически невыгодным и химическая связь между атомами не возникает. При противоположно направленных спинах (рис. 10, кривая б) сближение атомов до некоторого расстояния r0 сопровождается уменьшением энергии системы. При r = r0 система обладает наименьшей потенциальной энергией, т. е. находится в наиболее устойчивом состоянии; дальнейшее сближение атомов вновь приводит к возрастанию энергии. Но это и означает, что в случае противоположно направленных спинов атомных электронов образуется молекула Н2 - устойчивая система из двух атомов водорода, находящихся на определенном расстоянии друг от друга.
 |
|
Рис. 10. Энергия системы, состоящей из двух атомов водорода |
Образование химической связи между атомами водорода является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов. Вследствие такого взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков. Это притяжение преобладает над взаимным отталкиванием одноименно заряженных электронов, так что в результате образуется устойчивая молекула.
Полученные Гейтлером и Лондоном расчетные значения межъядерного расстояния и энергии связи в молекуле водорода оказались близки к экспериментально найденным величинам. Это означало, что приближения, использованные Гейтлером и Лондоном при решении уравнения Шредингера, не вносят существенных ошибок и могут считаться оправданными. Таким образом, исследование Гейтлера и Лондона позволяло сделать вывод, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам.
Наличие спаренных или неспаренных электронов в атомах, ионах или молекулах устанавливается экспериментально изучением магнитных свойств. Вещества c неспаренными электронами парамагнитны, т. е. эти вещества проводят магнитные силовые линии лучше, чем вакуум, и магнитное поле втягивает эти вещества. Это вызвано взаимодействием спинов электронов как элементарных магнитов с внешним магнитным полем. Парамагнитны атомы водорода.
Вещества, имеющие спаренные электроны, диамагнитны, т. е. они проводят магнитные силовые линии хуже, чем вакуум, и магнитное поле их выталкивает. Диамагнитны молекулы H2, N2O4, атомы Не, Аr и др.
Не будем больше останавливаться на деталях сложной и хорошо разработанной теории химических связей. Можно только сказать, что в настоящее время многие из квантовых аспектов химической физики проникли и в старую физическую химию, «заразив» ее новыми квантовыми идеями. В заключение отметим, что современная химия прочно встала на строгий в математическом смысле количественный путь своего развития.
3.5. Строение веществ в разных агрегатных состояниях
Все вещества могут находиться в разных агрегатных состояниях - твердом, жидком, газообразном и плазменном. Опыт показывает, что границы между агрегатными состояниями весьма условны. Газы при низких давлениях и невысоких температурах рассматриваются как идеальные, молекулы в них соответствуют материальным точкам, которые могут только сталкиваться по законам упругого удара. Силы взаимодействия между молекулами в момент удара пренебрежимо малы, сами соударения происходят без потерь механической энергии. Но с увеличением расстояния между молекулами приходится учитывать и взаимодействие молекул. Эти взаимодействия начинают сказываться при переходе из газообразного состояния в жидкое или твердое. Между молекулами могут возникнуть разного рода взаимодействия.
Силы межмолекулярного взаимодействия не обладают насыщаемостью, отличаясь от сил химического взаимодействия атомов, приводящего к образованию молекул. Они могут быть электростатическими при взаимодействии между заряженными частицами. Опыт показал, что квантово-механическое взаимодействие, зависящее от расстояния и взаимной ориентации молекул, пренебрежимо мало при расстояниях между молекулами более 10-9 м. В разреженных газах им можно пренебречь или считать, что потенциальная энергия взаимодействия практически равна нулю. При небольших расстояниях r эта энергия мала, при r > r0 действуют силы взаимного притяжения (F < 0), при r > r0 - взаимного отталкивания (F >0), а при r = r0 силы притяжения и отталкивания молекул уравновешены и F = 0. Здесь силы определены по связи их с потенциальной энергией F= -dE/dr. Но частицы движутся, обладая неким запасом кинетической энергии. Пусть одна молекула неподвижна, а другая сталкивается с ней, имея такой запас энергии. При сближении молекул силы притяжения совершают положительную работу, и потенциальная энергия их взаимодействия уменьшается до расстояния r, при этом кинетическая энергия (и скорость) растет. Когда расстояние станет меньше r0, силы притяжения сменятся силами отталкивания. Работа, совершаемая молекулой против этих сил, отрицательна. Молекула будет сближаться с неподвижной молекулой до тех пор, пока ее кинетическая энергия не перейдет полностью в потенциальную. Минимальное расстояние d, на которое молекулы могут сблизиться, называют эффективным диаметром молекулы. После остановки молекула начнет удаляться под действием сил отталкивания с возрастающей скоростью. Пройдя вновь расстояние r, молекула попадет в область сил притяжения, которые замедлят ее удаление. Эффективный диаметр зависит от начального запаса кинетической энергии, т. е. это величина не постоянная. При расстояниях, равных r0 , потенциальная энергия взаимодействия имеет бесконечно большое значение или «барьер», препятствующий сближению центров молекул на меньшее расстояние. Отношение средней потенциальной энергии взаимодействия к средней кинетической энергии α и определяет агрегатное состояние вещества: для газов α << 1, для жидкости α = 1, для твердых тел α >> 1.
Конденсированные среды - это жидкости и твердые тела. В них атомы и молекулы расположены близко, почти соприкасаясь. Среднее расстояние между центрами молекул в жидкостях и твердых телах порядка (2 - 5)·10-10 м. Примерно одинаковы и их плотности. Межатомные расстояния превышают расстояния, на которые электронные облака проникают друг в друга настолько, что возникают силы отталкивания. Для сравнения: в газах при нормальных условиях среднее расстояние между молекулами порядка 33·10-10 м.
Жидкости
 |
|
Рис.11. Примеры проявления поверхностного натяжения |
Жидкость является агрегатным состоянием вещества, промежуточным между газообразным и твердым. В газах нет закономерности во взаимном расположении молекул (хаотическое расположение). В твердых телах наблюдается дальний порядок - молекулы образуют кристаллическую решетку. В жидкостях дальний порядок отсутствует, а имеет место ближний порядок в расположении молекул - их упорядоченное расположение повторяется на расстояниях, сравнимых с межатомными. Тепловое движение молекулы в жидкости - это ее колебание около определенного положения равновесия в течение некоторого времени, после чего молекула скачком переходит в новое положение, отстоящее от исходного на расстояние порядка межатомного.
Молекулы поверхностного слоя жидкости обладают большей потенциальной энергией, чем молекулы внутри жидкости. Эта дополнительная энергия, называемая поверхностной энергией, пропорциональна площади поверхности: ∆E = σ∆S, где σ - поверхностное натяжение. Поверхностный слой жидкости аналогичен растянутой упругой пленке, в которой действуют силы натяжения (рис. 11).
Так как равновесное состояние характеризуется минимумом потенциальной энергии, то жидкость при отсутствии внешних сил будет принимать такую форму, чтобы при заданном объеме она имела минимальную поверхность, т. е. форму шара.
 |
|
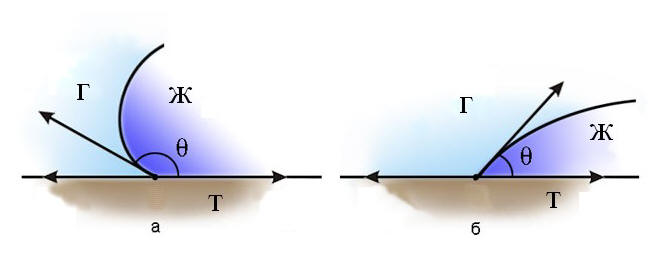
Рис. 12. Краевой угол смачивания |
Смачиванием называется явление искривления свободной поверхности жидкости при соприкосновении жидкости с поверхностью твердого тела.
Явление смачивания характеризуется краевым углом Θ между поверхностью твердого тела и в точках периметра смачивания (рис. 12). Жидкость называется смачивающей твердое тело, если краевой угол острый: 0 ≤ Θ < π/2, и несмачивающей, если π/2 < Θ< π.
Если Θ = 0, смачивание считается идеальным (полным). Случай Θ = π - это идеальное (полное) несмачивание. Если силы притяжения между молекулами твердого тела и жидкости больше, чем силы притяжения молекул жидкости друг к другу, то жидкость будет смачивающей. Если молекулярное притяжение в жидкости превышает силы притяжения молекул жидкости к молекулам твердого тела, то жидкость не смачивает твердое тело.
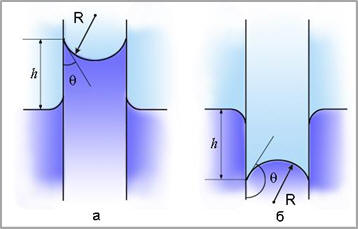
Капиллярами называются узкие цилиндрические трубки с диаметром менее миллиметра. Капиллярностью называется явление изменения уровня жидкости в капиллярах. Жидкость в капилляре поднимается или опускается на такую высоту h, при которой давление столба жидкости (гидростатическое давление) ρgh уравновешивается избыточным давлением ∆р: 2σ/R = ρgh (рис. 13).
 |
|
Рис. 13 Капиллярность |
Высота поднятия (глубина опускания) жидкости в капилляре:
h = 2σ/pgR = 2σ cosΘ/pgr
где ρ - плотность жидкости, r - радиус капилляра, R - радиус кривизны мениска, g - ускорение свободного падения. Высота поднятия (опускания) жидкости в капилляре обратно пропорциональна его радиусу.
Капиллярными явлениями объясняется свойство ряда тел впитывать влагу (гигроскопичность). Для сохранения подпочвенной влаги в почве капилляры разрушают при вспашке и бороновании. Иначе влага в почве поднимается по капиллярам на поверхность и испаряется. Для того чтобы влага не проникала в помещение по капиллярам, между фундаментом здания и стенами прокладывают гидроизолирующий слой, препятствующий явлению капиллярности. Благодаря капиллярности возможна жизнедеятельность животных и растений.
Твердые тела
Твердым телом называется агрегатное состояние вещества, характеризующееся постоянством формы и объема, причем тепловые движения частиц в них представляют собой хаотические колебания частиц относительно положений равновесия.
Твердые тела подразделяются на кристаллические и аморфные.
Кристаллические тела - это твердые тела, имеющие упорядоченное, периодически повторяющееся расположение частиц. Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. Точки, в которых расположены частицы, а точнее средние равновесные положения, около которых частицы совершают колебания, называются узлами кристаллической решетки.
 |
|
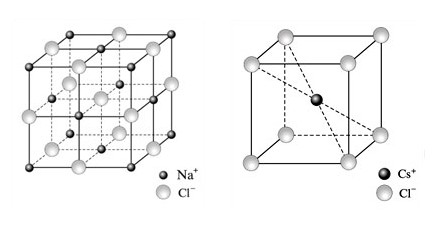
Рис. 14. Кристаллические решетки NaCl и CsCl |
Характерной особенностью кристаллов является их анизотропность - зависимость физических свойств (упругих, механических, тепловых, электрических, магнитных, оптических) от направления. Анизотропия кристаллов объясняется тем, что плотность расположения частиц по разным направлениям не одинакова.
В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия между ними кристаллы подразделяются на четыре типа: ионные, атомные, металлические, молекулярные.
Ионные кристаллы. В узлах кристаллической решетки располагаются поочередно ионы противоположного знака. Структуры решеток двух наиболее характерных ионных кристаллов - NaCl (решетка представляет собой две одинаковые гранецентрированные кубические решетки, вложенные друг в друга; в узлах одной из этих решеток находятся ионы Na+, в узлах другой - ионы Сl) и CsCl (кубическая объемноцентрированная решетка - в центре каждой элементарной ячейки находится ион) - показаны на рис. 14. Связь, обусловленная кулоновскими силами притяжения между разноименно заряженными ионами, называется ионной.
Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решетки ковалентными связями квантово-механического происхождения (у соседних атомов обобществляются валентные электроны, наименее связанные с атомом). Пример атомных кристаллов - алмаз и графит. В алмазе каждый атом углерода связан с четырьмя такими же атомами, которые располагаются на одинаковых расстояниях от него в вершинах тетраэдра (рис. 15, а). Сильные ковалентные связи между соседними атомами, пронизывающие, как каркас, всю структуру кристалла, придают таким твердым веществам большую прочность и обусловливают высокую температуру плавления. Алмаз сублимирует (не плавится, а сразу возгоняется в паровую фазу) при температурах выше 350 °С. Алмаз — прозрачное кристаллическое вещество, самое твердое из всех природных веществ.
 |
 |
 |
 |
 |
 |
 |
 |
| а | б | в | г |
|
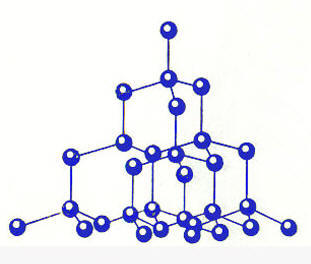
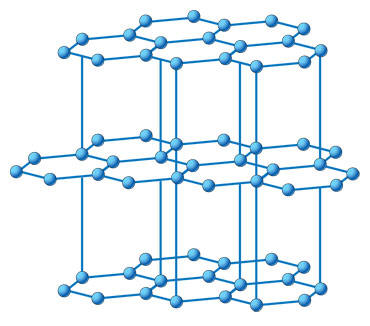
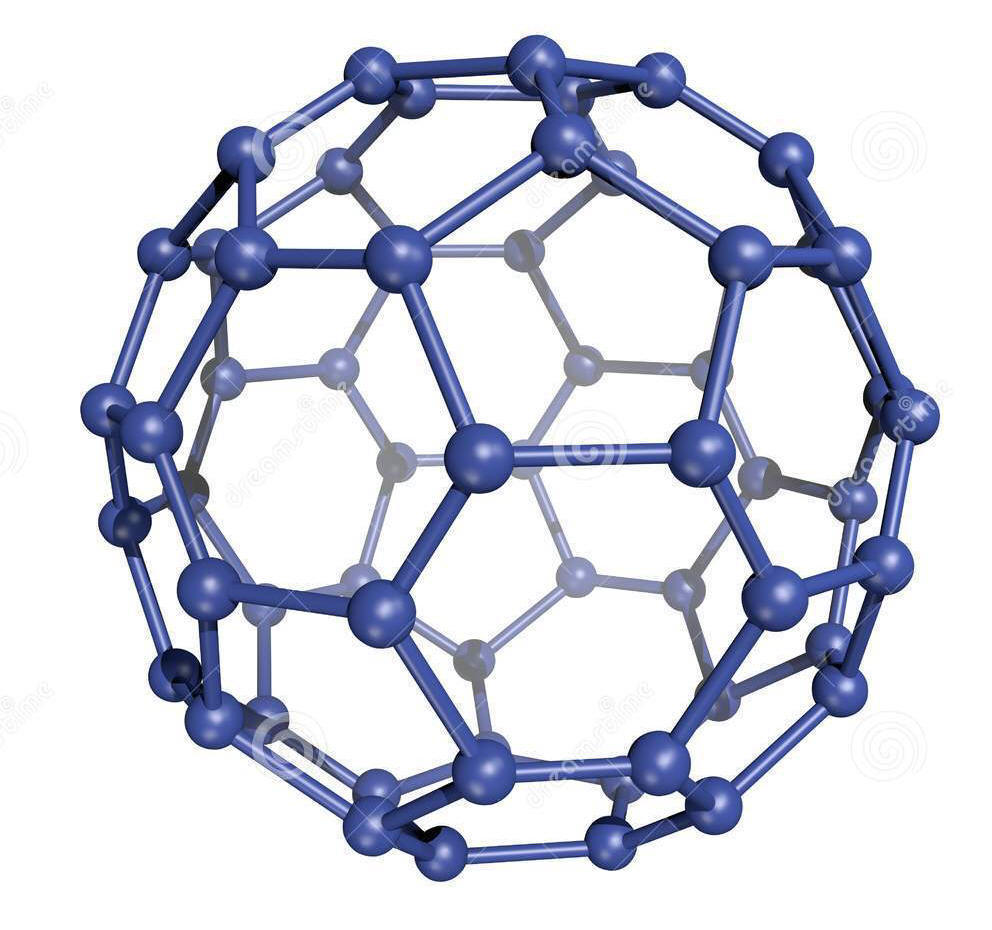
Рис. 15. Кристаллические решётки алмаза (а), графита (б), фуллерена (в) и графена (г) |
|||
В других условиях те же атомы углерода кристаллизуются в графит. В графите они соединены тоже атомными связями, но образуют плоскости из шестиугольных сотовидных ячеек, способных к сдвигу. Расстояние между атомами, расположенными в вершинах шестигранников, равно 0,142 нм. Слои расположены на расстоянии 0,335 нм, т. е. связаны слабо, поэтому графит пластичен и мягок (рис. 15, б). Графит — темно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском, хорошо проводит тепло и электрический ток.
В 1990-е году возник бум исследовательских работ, вызванный сообщением о получении нового вещества - фуллерита, состоящего из молекул углерода - фуллеренов. Она названа в честь архитектора Р. Фуллера, который в 1954 году получил патент на строительные конструкции из шестиугольников и пятиугольников, составляющих полусферу. Молекула из 60 атомов углерода диаметром 0,71 нм была открыта в 1985 г., потом были обнаружены молекулы С70 , С76, С84 и т. д. Все они имели устойчивые поверхности, но наиболее устойчивыми оказались молекулы С60 и С70.
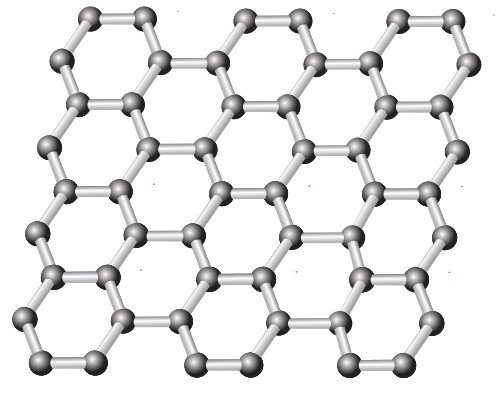
В 2004 году была открыта новая аллотропная модификация углерода - графен. Графен – двумерная аллотропная модификация углерода, образованная слоем толщиной в один атом, организованным в гексагональную кристаллическую решетку. Его можно представить как плоскость, срез графита, отделенный от объемного кристалла. Графен обладает огромной механической прочностью и рекордно высокой теплопроводностью. Необычайно высокая подвижность электронов в нем делает графен перспективным материалом для использования в самых различных приложениях, в частности как будущую основу наноэлектроники и возможную замену кремния в интегральных микросхемах.
Металлические кристаллы. В узлах кристаллической решетки располагаются положительные ионы металла. При образовании кристаллической решетки валентные электроны, слабо связанные с атомами, отделяются от атомов и коллективизируются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае ковалентной связи, а всему кристаллу в целом.
Молекулярные кристаллы. В узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эти силы называются ван-дер-ваальсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности. Примеры молекулярных кристаллов - органические соединения (например, парафин), инертные газы (Ne, Ar, Кr, Хе) и атмосферные газы СО2, О2, N2 в твердом состоянии, лед и т. д.
Твердые тела, физические свойства которых одинаковы по всем направлениям (изотропны), называются аморфными. Для аморфных тел, как и для жидкостей, характерен ближний порядок в расположении частиц, но, в отличие от жидкостей, подвижность частиц в них довольно мала.
Газы
Газ - агрегатное состояние вещества, характеризующееся очень слабыми связями между составляющими его частицами, а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения.
Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром.
Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуд).
Газообразное состояние - самое распространённое состояние вещества Вселенной. По химическим свойствам газы и их смеси весьма разнообразны - от малоактивных инертных газов до взрывчатых газовых смесей. К газам относят не только системы из атомов и молекул, но и системы из других частиц - фотонов, электронов, а также плазму.
Плазма
Плазма - четвертое агрегатное состояние вещества, представляющее собой газ из совокупности заряженных частиц, взаимодействующих на больших расстояниях. При этом число положительных и отрицательных зарядов примерно равное, так что плазма электрически нейтральна. Чтобы перевести газ в состояние плазмы, нужно его ионизовать, оторвать электроны от атомов. Ионизацию можно осуществить нагреванием, воздействием электрического разряда или жесткого излучения. Вещество во Вселенной находится в основном в ионизованном состоянии. В звездах ионизация вызывается термически (Т ≈ 106 К), в разреженных туманностях и межзвездном газе - ультрафиолетовым излучением звезд. Из плазмы состоит Солнце, его излучение ионизует верхние слои земной атмосферы (ионосферу). В земных условиях плазма встречается в лампах дневного света или в дуге электросварки. В лабораториях и технике плазму чаще всего получают электрическим разрядом. Используют и ионизацию давлением - ударными волнами. Этот способ ионизации - в сверхплотных звездах и, возможно, в ядре Земли.
Фазовые переходы
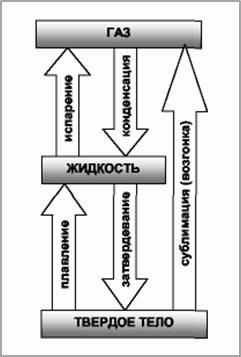
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
Переход вещества из одной фазы в другую (рис. 16) - фазовый переход - всегда связан с качественными изменениями свойств веществ.
 |
| Рис. 16. Фазовые переходы |
Фазовый переход первого рода - это переход, сопровождающийся поглощением или выделением теплоты (например, плавление, кристаллизация). Он характеризуется постоянством температуры, изменениями энтропии и объема.
Фазовый переход второго рода - переход, не связанный с поглощением или выделением теплоты и изменением объема. Он характеризуется постоянством объема и энтропии, но скачкообразным изменением теплоемкости.
И в жидкостях, и в твердых телах всегда есть некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны покинуть поверхность жидкости или твердого тела. Такой процесс для жидкости называется испарением, для твердых тел - сублимацией (или возгонкой).
Конденсацией называется переход вещества вследствие его охлаждения или сжатия из газообразного состояния в жидкое.
Если число молекул, покидающих жидкость за единицу времени через единичную поверхность, равно числу молекул, переходящих из пара в жидкость, то наступает динамическое равновесие между процессами испарения и конденсации. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
Плавлением называется переход вещества из кристаллического (твердого) состояния в жидкое. Плавление происходит при определенной, возрастающей с увеличением внешнего давления, температуре плавления Тпл.
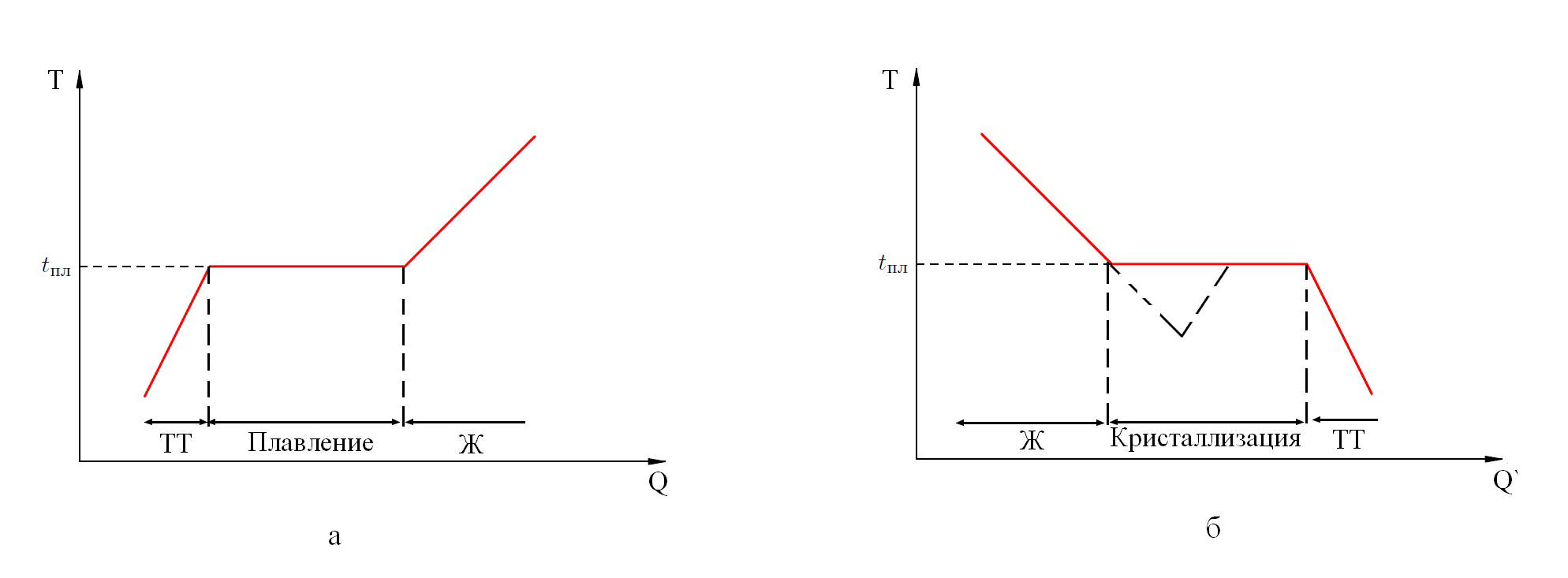
График изменения температуры твердого вещества при переходе им точки плавления сам по себе весьма интересен. До точки плавления по мере нагревания атомы/молекулы раскачиваются вокруг своего фиксированного положения всё сильнее, и поступление каждой дополнительной порции тепловой энергии приводит к повышению температуры твердого тела. Однако по достижении твердым веществом температуры плавления оно на какое-то время так и остается при этой температуре, несмотря на продолжающийся приток тепла.
В процессе плавления теплота Q, сообщаемая веществу, идет на совершение работы по разрушению кристаллической решетки, и поэтому Тпл = const (рис. 17, а) до расплавления всего кристалла. Количество теплоты, необходимое для расплавления 1кг вещества, называется удельной теплотой плавления.
 |
|
Рис. 17. Графики плавления (а) и кристаллизации (б) |
Если жидкость охлаждать, то процесс пойдет в обратном направлении, (Q' - количество теплоты, отдаваемое телом при кристаллизации): сначала температура жидкости понижается, затем при постоянной температуре, равной Тпл, начинается кристаллизация.
Для кристаллизации вещества необходимо наличие центров кристаллизации - кристаллических зародышей, которыми могут быть как кристаллики образующегося вещества, так и любые инородные включения. Если в чистой жидкости нет центров кристаллизации, то она может быть охлаждена до температуры, меньшей температуры кристаллизации, образуя при этом переохлажденную жидкость (рис. 17, б - пунктир).


