
8. Химические процессы в гидросфере и атмосфере

Самый распространенный минерал на Земле - это вода. Вода входит в состав всех живых организмов. Тело человека, например, на 65 % состоит из воды. Грибы, водоросли и растения могут содержать до 98 % этого вещества. На земном шаре содержится около 1,5 млрд км3 воды, которая образует водную оболочку планеты - гидросферу. На океаны и моря приходится 97,4 % воды и только 2,6 % - это пресные воды. Более 3/4 всей пресной воды находится в ледниках, где она находится в твердом состоянии. Почти четверть запасов пресных вод составляют подземные воды. Лишь 280 тыс. км3 - это поверхностные воды суши (озера, водохранилища, реки, болота), 14 тыс. км3 пресной воды находится в атмосфере в газообразном состоянии.
Благодаря тому, что вода может переходить из одного агрегатного состояния в другое, в природе происходит непрерывный процесс перемещения воды из Мирового океана на сушу, а с суши - снова в Мировой океан. Этот непрерывный процесс называется круговоротом воды в природе (рис. 6).
 |
|
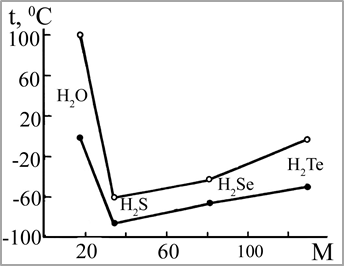
Рис. 37. Зависимость температуры плавления (●) и кипения (○) водородных соединений элементов главной подгруппы VI группы от молекулярной массы |
Воду еще с древних времен рассматривали как основу жизни. У Аристотеля она входила в число четырех неуничтожимых элементов, или «начал», и ее соединение с другими «началами» - землей, огнем и воздухом - порождало все многообразие мира. К XIX веку свойство воды быть элементом трансформировалось в свойство быть растворителем и важнейшим компонентом объектов живой и неживой природы.
Вода - это простейшее соединение водорода с кислородом, по массе вода состоит из 11,19 % водорода и 88,81 % кислорода. Вследствие существования трех изотопов водорода и шести изотопов кислорода существует 36 изотопных разновидностей воды.
Удивительны и уникальны свойства воды! Почти все ее физико-химические параметры не имеют аналогов в природе. Некоторые из этих аномалий имеют определяющее значение для формирования климата и рельефа нашей планеты, жизни животных и растений. Если бы не эти «ненормальные» свойства, живые организмы не могли бы сохранять температуру своего тела, усваивать питательные вещества. Иными словами, если бы не особые свойства воды, жизнь на планете Земля в современной ее форме была бы просто невозможна!
Физические свойства воды совершенно аномальны. Самое удивительное из них - это способность ее при нормальных условиях быть жидкостью. Молекулы похожих на нее химических соединений (H2S, H2Se или Н2Те) намного тяжелее воды, но при этих условиях газообразны. Обычно в ряду однотипных соединений элементов данной подгруппы температуры плавления и кипения с увеличением атомной массы элемента возрастают. Это объясняется усилением взаимного притяжения молекул, что связано с увеличением размеров атомов и с ростом дисперсионного взаимодействия между ними. И если бы для воды эта зависимость сохранилась, она была бы жидкой лишь в диапазоне от -80 до -95 °С, а при более высоких температурах была бы газом. Однако, как показывает рис. 37, вода плавится и кипит при аномально высоких температурах.
Конечно, это свойство, как и другие, очень важно для всей биосферы. Кроме того, совершенно аномален сам диапазон существования воды в жидкой фазе - 100 °С.
 |
|
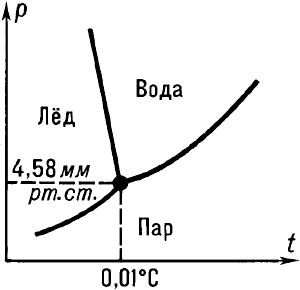
Рис. 38. Тройная точка воды |
Тройная точка воды, т. е. равновесие воды, льда и пара, наблюдается при температуре 0,01 °С и давлении 611 Па (рис. 38). Переохлажденная вода, т. е. остающаяся в жидком состоянии ниже 0 °С, ведет себя странно: с одной стороны, плотность ее уменьшается при понижении температуры, с другой - приближается к плотности льда. Необычайно велики пределы допустимых значений переохлаждения и перегрева воды: можно продержать ее в жидком состоянии при температуре от -40 до +200 °С.
В отличие от большинства других жидкостей, при повышении температуры ее удельный объем уменьшается, а плотность увеличивается, достигая минимума (соответственно, максимума) при 4 °С. При замерзании объем воды увеличивается до 10 %. Плотность воды больше плотности льда. При плавлении кристаллов, когда регулярность упаковки ионов нарушается, плотность уменьшается на 2-4 %. Это свойство воды предохраняет водоемы от сплошного промерзания, спасая в них жизнь.
Большое значение в жизни природы имеет, например, тот факт, что вода обладает высокой теплоемкостью. Поэтому в ночное время, а также при переходе от лета к зиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, самым главным регулятором температуры на земном шаре. Поэтому моря и океаны являются гигантскими термостатами, сглаживая все колебания температуры воздуха. Кстати, эти же функции может выполнять и водяной пар в атмосфере. Отсутствие водяного пара в пустынях приводит к резким колебаниям ночной и дневной температур. В отличие от обычных жидкостей, с ростом температуры в интервале от 0 до 150 °С теплопроводность воды растет, а вязкость уменьшается. При плавлении льда теплоемкость испытывает скачок от 37,8 до 75,6 Дж/(моль∙К), т. е. в 2 раза. Этот скачок теплоемкости после плавления означает, что в воде появились очень энергоемкие процессы, на которые нужно истратить подводимую теплоту. И эти процессы сохраняются, пока вода находится в жидком состоянии. У переохлажденной воды эта аномалия теплоемкости еще больше.
Электропроводность воды зависит от примесей, но даже в очищенной воде она не нулевая. Это связано с частичной диссоциацией ее на ионы Н+ и ОН-. Диэлектрическая постоянная воды также аномальна - достигает 81 (у других жидкостей - менее 10). В переменных электрических полях она начинает зависеть не только от частоты приложенного поля, сильно уменьшаясь для высокочастотных полей, но и от пространственных колебаний полей. Под действием жесткого излучения вода распадается на свободные радикалы, при этом образуются водород и перекись водорода.
Аномальность свойств воды связана со строением ее молекул и структуры в разных агрегатных состояниях, а также способностью образовывать водородные связи. Хорошая модель молекулы воды - правильный тетраэдр. Ядра в молекуле Н2O образуют равнобедренный треугольник с двумя протонами в основании и кислородом в вершине. Угол НОН равен 105°, расстояние О-Η равно 0,957 · 10-8 м.

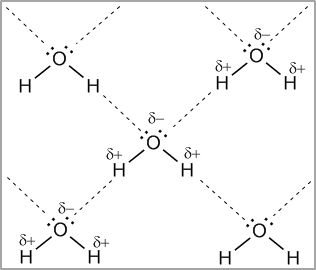
Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную (рис. 39).
 |
|
Рис. 39. Водородные связи между молекулами воды |
Энергия связи водородной связи Н---О в димере воды составляет 21,5 кДж/моль, а ее длина 2,04 Å. Таким образом, эти связи более длинные и примерно в 10-20 раз менее прочные, чем обычные ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
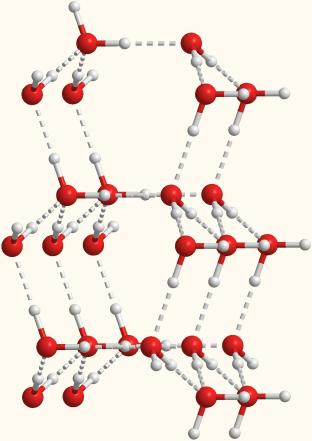
В жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты - все крупнее. Наконец, образуется лед, который имеет упорядоченную структуру, изображенную на рис. 40. Видно, что в кристалле льда между молекулами остаются пустоты. Объем пустот чуть больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода, и плавает на поверхности. Большинство же других веществ при замерзании увеличивает свою плотность.
Химические свойства воды связаны с полярностью молекулы и строением ее электронной оболочки. Вода легко вступает в химические соединения, образуя гидроокиси. Щелочные и щелочноземельные металлы разлагают воду при обычной температуре - образуются водород и гидроокись. При повышенной температуре со всеми металлами происходит такая же реакция. Взаимодействие с водой ведет к коррозии металлов.
Одним из самых замечательных и в то же время затрудняющим изучение воды свойством является способность воды выступать в качестве универсального растворителя. В воде растворяется гораздо больше веществ, чем в любой другой жидкости, поэтому вода всегда является раствором, имеющим сложный химический состав.
Следует отметить, что в природе не существует абсолютно чистой воды, а наиболее близкой к этому понятию является дождевая вода, хотя даже она в своем составе имеет некоторое количество примесей, которые попадают в нее из воздуха. В зависимости от содержания в воде различных примесей ее можно разделить на несколько классов: пресную воду, соленую и рассолы.
 |
|
Рис. 40. Структура льда |
Когда вещество переходит в раствор, его молекулы или ионы могут более свободно двигаться, и реакционная способность возрастает. Большая часть реакций в живой клетке идет в водном растворе. Такие гидрофильные свойства полярных молекул важны в обеспечении стабильности мембран, белковых молекул, нуклеиновых кислот и других субклеточных структур. Неполярные вещества, такие как липиды, с водой не смешиваются и разделяют водные растворы на отдельные компоненты, как их разделяют мембраны. Поэтому неполярные части молекул водой отталкиваются и в присутствии воды притягиваются друг к другу, или обладают гидрофобным эффектом, например, сливание капелек масла в большую каплю и нерастворение ее в воде. Свойство воды - растворителя важно для транспортировки по организму разных веществ.
Жесткость воды - определенное свойство воды, которое связывают с растворенными в ней соединениями магния и кальция, то есть наличием в воде катионов этих элементов (при повышении температуры соли этих металлов выпадают в осадок и образуют весьма прочные отложения). Жесткость воды во многом определяет пригодность воды для использования как в промышленных, так и в бытовых целях. Возникновением накипи мы обязаны именно жесткой воде.
Жесткость воды принято исчислять суммой миллимолей ионов кальция и магния на 1 литр воды (ммоль/л). Для удобства пользуются величиной мг-экв/л, которая соответствует моль/м3.
Выделяют два типа жесткости воды:
-
временная - карбонатная жесткость, обусловлена присутствием гидрокарбонатных анионов;
-
постоянная - некарбонатная жесткость, характеризуется присутствием сульфатных, нитратных и хлоридных анионов.
Общая жесткость определяется суммой карбонатной и некарбонатной жесткости.
Принято классифицировать жесткость воды следующим образом:
-
мягкая вода - жесткость до 3,0 мг-экв/л;
-
средняя жесткость - от 3,0 до 6,0 мг-экв/л;
-
жесткая вода - свыше 6,0 мг-экв/л.
Причиной жесткости воды является подземные залежи известняков, гипса, доломитов, которые растворяются в подземных водах, а также отчасти процессов растворения и выветривания горных пород.
Приемлемость жесткости воды для питьевых нужд зависит от конкретных местных условий. Порог вкуса для иона кальция находится в диапазоне 2-6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния - значительно ниже (в отдельных случаях приемлема вода жесткостью в 10 мг-экв/л). Жесткая вода имеет горьковатый вкус и негативно воздействует на органы пищеварения, органолептические свойства воды отвечают низкому уровню.
Одним из способов устранения жесткости воды является термоумягчение. Он основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
Кипячение устраняет только временную (карбонатную) жёсткость.
Метод реагентного умягчения основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O.
8.2. Методы очистки воды
Природная вода содержит различные органические вещества и биологические загрязнения. Они придают ей цветность, запах, привкус, служат источником заражения болезнетворными микроорганизмами. В воде также содержатся катионы тяжелых металлов низшей валентности, например, железо и марганец, анионы в высшей валентности и растворенные газы, например, гидросульфаты и сероводород. Для того чтобы воду сделать безвредной, прозрачной и приятной на вкус, ее требуется сначала очистить. Методы очистки воды от загрязнений разнообразны.
Наиболее дешевая - механическая очистка - применяется для выделения взвесей. Основные методы: процеживание, отстаивание, обработка в поле действия центробежных сил и фильтрование. Применяются как предварительные этапы водоподготовки.
Биологическая очистка основана на способности микроорганизмов использовать для питания содержащиеся в сточных водах органические вещества (кислоты, спирты, белки, углеводы и т. п.). Процесс реализуется как в аэробных, так и в анаэробных условиях в зависимости от видов и свойств микроорганизмов. Биологическую очистку осуществляют в природных и искусственных условиях.
В настоящее время в связи с использованием оборотных систем водоснабжения существенно увеличивается применение физико-химических методов очистки сточных вод, основными из которых являются флотация и сорбция.
Флотация предназначена для извлечения из воды гидрофобных частиц (нефтепродукты) пузырьками газа, подаваемого в сточную воду. В основе этого процесса имеет место слипание частиц масла и пузырьков тонкодиспергированного в воде газа. Образование агрегатов «частица - пузырьки газа» зависит от интенсивности их столкновения друг с другом, химического взаимодействия содержащихся в воде веществ, избыточного давления газа в сточной воде и т. п. Разновидность метода - электрофлотация, при которой вода дополнительно обеззараживается за счет окислительно-восстановительных процессов у электродов.
Сорбцию применяют для очистки жидкостей и газов от растворимых примесей. Процессы сорбции могут протекать:
-
на поверхности (адсорбция);
-
в объеме (абсорбция).
Адсорбция - процесс избирательного поглощения примесей из жидкостей или газов поверхностями твердых материалов - адсорбентов. Особенностью адсорбционных методов улавливания примесей является их относительно высокая эффективность в области малых концентраций примесей при значительных расходах перерабатываемых потоков.
Различают два вида адсорбции:
-
физическая адсорбция, протекает за счет сил молекулярного взаимодействия;
-
химическая адсорбция (хемосорбция), протекает за счет вступления в химическую реакцию молекулы поглощаемого вещества с молекулами поверхности адсорбента.
Процесс физической адсорбции обратимый, поэтому на практике после стадии адсорбции часто проводят обратный процесс - десорбции. Необходимость десорбции обусловлена либо требованием регенерации адсорбента для его последующего использования в процессе адсорбции, либо необходимостью выделить целевой компонент в чистом или концентрированном виде. В качестве адсорбентов используют любые мелкодисперсные материалы: золу, торф, цеолиты, силикагели, опилки, шлаки и глину. Наиболее эффективный сорбент - активированный уголь.
Ионообменный метод очистки воды применяют для обессоливания и очистки воды от ионов металлов и других примесей. Сущность ионного обмена заключается в способности ионообменных материалов забирать из растворов электролита ионы в обмен на эквивалентное количество ионов ионита. Позволяет извлекать и утилизировать из сточных вод соединения мышьяка, фосфора, а также хром, цинк, свинец, медь, ртуть и радиоактивные вещества.
Коагуляция - процесс слипания твердых частиц в момент их соприкосновения. Очистка воды коагуляцией представляет собой обработку воды реагентами - коагулянтами, под действием которых мельчайшие частицы загрязнителей укрупняются, слипаются в хлопья. Коагуляция обеспечивает эффективное дальнейшее задержание примесей механическими фильтрами или выпадение примесей в осадок. Стоит заметить, что коагуляция особенно эффективна при очистке воды от примесей железа. В качестве коагулянтов обычно используют соли алюминия, железа или их смеси.
Экстракция - процесс разделения примесей в смеси двух нерастворимых жидкостей (экстрагента и сточной воды). С помощью жидкостной экстракции очищают сточные воды от фенолов, масел, жирных кислот. Целесообразность использования этого метода определяется концентрацией органических примесей в сточных водах.
Гиперфильтрация (обратный осмос) - процесс непрерывного молекулярного разделения растворов путем их фильтрования под давлением через полупроницаемые мембраны, задерживающие полностью или частично молекулы либо ионы растворенного вещества. При этом размеры отделяемых частиц (молекул, гидратированных ионов) сопоставимы с размерами молекул растворителя (воды). По сравнению с другими методами очистки гиперфильтрация требует малых энергозатрат, установки для очистки конструктивно просты и компактны, легко автоматизируются, фильтрат имеет высокую степень чистоты и может быть использован в оборотных системах водоснабжения, а сконцентрированные примеси сточных вод легко утилизируются.
Эвапорационная очистка производится путём пропускания через нагретую приблизительно до 100 °C сточную воду водяного пара. Проходя через воду, пар увлекает загрязняющие её летучие вещества, после чего очищается от них при прохождении через также нагретое до ≈ 100 °C вещество-поглотитель и поступает для повторного использования. Основными преимуществами эвапорационного способа очистки являются относительная простота при высоких технико-экономических показателях и отсутствие добавочного загрязнения в виде реагентов, остающихся в воде.
Одним из путей улучшения качества воды является обработка ее окислителями. Основными окислителями, используемыми в водоподготовке, являются: кислород воздуха, хлор, другие галогены, диоксид хлора СlO2, гипохлорит натрия NаClO, озон, перманганат калия KMnO4; пероксид водорода H2O2.
Кислород является достаточно слабым окислителем. Он практически не действует на растворенные органические вещества, а для биологических объектов является необходимым элементом их существования и размножения. В то же время кислород окисляет растворенные в воде катионы тяжелых металлов (железо и марганец) до их высших валентностей, при которых они легче гидролизуются и затем удаляются фильтрованием. Другие, более сильные окислители не только окисляют неорганические ионы, но и дезинфицируют и дезодорируют воду.
В мировом масштабе первое место среди дезинфицирующих воду веществ занимает хлор и его соединения. Хлор действует на органические вещества, окисляя их, и на бактерии, которые погибают в результате окисления веществ, входящих в состав протоплазмы клеток. Хлор обладает высокой дезинфицирующей способностью, относительно стоек и длительное время сохраняет активность. Он легко дозируется и контролируется. К его недостаткам относятся: высокая токсичность, трудность обеспечения жидким хлором удаленных объектов. При реакциях с органическими веществами происходит образование тригалогенметанов и хлорфенолов, придающих воде запах, а также чрезвычайно токсичных диоксинов. Из-за этого требуется последующая доочистка воды. Постоянно проводятся исследования по замене хлора на реагенты, имеющие близкую окислительную способность, но лишенные его недостатков.
 Одним
из наиболее перспективных способов обеззараживания природной воды
является использование гипохлорита натрия благодаря его высокой
антибактериальной активности и широкому спектру действия на различные
микроорганизмы. Окислительное и бактерицидное действие гипохлорита натрия
идентично растворенному хлору, кроме того, он обладает пролонгированным
бактерицидным действием.
Одним
из наиболее перспективных способов обеззараживания природной воды
является использование гипохлорита натрия благодаря его высокой
антибактериальной активности и широкому спектру действия на различные
микроорганизмы. Окислительное и бактерицидное действие гипохлорита натрия
идентично растворенному хлору, кроме того, он обладает пролонгированным
бактерицидным действием.
Одним из наиболее сильных окислителей, уничтожающих бактерии, споры и вирусы, является озон. Озонирование является наиболее высокотехнологичным и эффективным методом обработки воды, распространенным в развитых странах. При озонировании, одновременно с обеззараживанием происходит обесцвечивание воды, а также ее дезодорация и улучшение вкусовых качеств. После взаимодействия с загрязняющими химическими и микробиологическими веществами озон превращается в обычный кислород.
Неисчерпаемый ранее ресурс - пресная вода - в настоящее время становится исчерпаемым. Во многих районах мира не хватает воды для питья, орошения, промышленного производства. Согласно данным Всемирной организации здравоохранения, сегодня более 2 млрд человек страдает от нехватки питьевой воды. По данным специалистов ЦРУ США в странах с хронической нехваткой воды проживает более половины населения планеты. Пресная вода стремительно превращается в дефицитный природный ресурс.


